Колхицин
Среди химических веществ, используемых для удвоения числа хромосом у растений, наиболее часто применяется колхицин. Колхицин – это растительный алколоид. Механизм его действия заключается в том, что проникая в делящуюся клетку он блокирует работу веретена деления, вследствие чего после удвоения числа хромосом не происходит разделения их по дочерним клеткам. Образуется одна клетка с удвоенным числом хромосом.. Удвоение числа хромосом может предусматривать разные цели. Например, восстановление плодовитости у стерильных растений (Работягов, 1987); преодоление барьера нескрещиваемости (Рудь, 1966); улучшение каких-либо свойств растений (величина плодов, изменение химического состава и др.) (Серебровская, 1974); получение новых полиплоидных форм, пригодных для использования в селекции (Dermen, 1965; Бавтуто, 1974, 1980; Лизнев, 1977 и др.).
Для обработки применяют как водный раствор колхицина разной концентрации, так и раствор колхицина в касторовом масле, глицерине, агар-агаре.
У плодовых и ягодных растений обрабатывают семена, проростки, молодые сеянцы, точки роста побегов и т.д. В результате таких обработок в большинстве случаев получают химерные растения разных типов, а иногда и гомогенные полиплоидные формы (Dermen, 1965; Лизнев, 1977; Геращенко, 1977, 1980).
В наших опытах обработка колхицином диплоидных сортов яблони была предпринята с целью получения нередуцированной пыльцы. Поэтому обработке подвергались генератативные почки в период прохождения мейоза в пыльниках.
Опыт проводили в условиях лаборатории на срезанных ветвях, поставленных в вегетационные сосуды с водой.
Схема опыта :
- Вариант 1 - контроль (срезанные ветви без обработки);
- Вариант 2 - 1% водный раствор колхицина (ветви в сосудах с раствором);
- Вариант 3 - 1% раствор колхицина в касторовом масле;
- Вариант 4 - 1% раствор колхицина в глицерине ;
- Вариант 5 - 0,5% раствор колхицина в глицерине;
- Вариант 6 - 0,5% раствор колхицина в касторовом масле.
В вариантах 3-6 раствор колхицина наносится пипеткой на каждую цветковую почку предварительно подготовленную следующим образом: лезвием безопасной бритвы осторожно, стараясь не повредить самих бутонов, удалялась верхушка цветковой почки – хитановые покровы, чашелистики и, частично, лепестки. Затем на свежий срез наносилась капля соответствующего раствора. Материал фиксировали на следующий день и далее - ежедневно, в течение всего времени, пока не завершится мейоз.
В вариантах с обработкой колхицином почти на всех стадиях наблюдаются отклонения от нормы (рис. 16). Однако нарушения, которые приводят к формированию гамет, обнаружены только в вариантах 3 и 6. В варианте 3 (1% раствор колхицина в касторовом масле) количество триад, содержащих одну диплоидную и две гаплоидных микроспоры составляет 11,3% от общего числа аномальных тетрад, в варианте (0,5% раствор колхицина в касторовом масле) – 3,2%. В остальных случаях крупные микроспоры имеют аномальное строение, что свидетельствует о явном нарушении распределения хроматина во время мейотического деления. В результате их оплодотворяющая способность снижена.
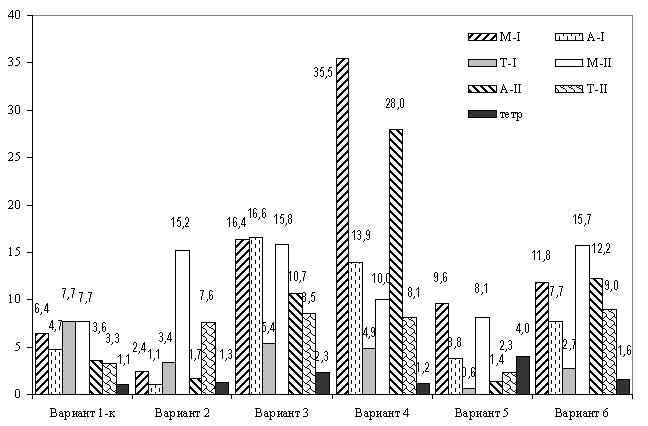
Рис. 16. Количество нарушений в ходе микроспорогенеза у яблони в разных вариантах обработки колхицином.
Вариант | Всего проанализировано клеток | В них оказалось гамет | в том числе, % | |||
анеуплоидных, % | ||||||
Контроль | 58 | 149 | 89,9 | 6, 7 | 3, 4 | 0 |
Обработка колхицином | 65 | 153 | 87, 6 | 6, 5 | 2, 6 | 3, 3 |
На примере триплоидного отдаленного гибрида вишни 74342 (вишня Любская х вишня сахаплинская Edwin Muller изучили еще один способ обработки кохицином генеративных почек в период прохождения мейоза. Обработку проводили в условиях сада. Для этого в момент начала мейоза (набухание почек, начало появления зеленого конуса) 0,5% водный раствор колхицина с помощью медицинского шприца с тонкой иглой вводили в цветковые почки. При этом иглой прокалывались кроющие чешуи у основания почки.
Раствор впрыскивался до тех пор, пока на верхушке цветковой почки не появится капля, что свидетельствует о максимальном заполнении раствором свободного пространства вокруг бутонов (способ введения колхицина с помощью медицинского шприца был предложен Джигадло М.И.). Такую процедуру повторяли троекратно на протяжении трех последующих дней. Бутоны фиксировали ежедневно до полного завершения мейоза.
Поскольку изучаемая нами форма является несбалансированным полиплоидом, большое число нарушений в ходе мейоза (контроль – от 56 до 98,2%; вариант с обработкой колхицином от 44 до 100%) является естественным следствием аномальной конъюгации хромосом. В среднем формула метафазы первого деления в контроле выглядит так: МI= 0,7I + 9,1II +1,4III + 0,2IV , в варианте с обработкой колхицином так: МI = 1,4I + 9,8II + 0,9III + 0,1IV. Характер нарушений на разных стадиях мейоза также идентичен как в контрольном варианте, так и в опытном. Однако при тщательном анализе характера мейоза прослеживается одна закономерность: начиная с анафазы первого деления в опытном варианте отмечен определенный процент микроспороцитов, где в результате блокирования веретена наблюдается нерасхождение хромосом. В следствие этого в телофазе-1 формируется микроспороцит с одним ядром (вместо двух в норме), в метафазе – 11 вместо двух групп хромосом (12 + 12) наблюдается одна группа из 24 хромосом. В конечном результате вместо обычных тетрад, формируются диады с нередуцированным числом хромосом.
Для представления о качестве формирования гамет у триплоидного гибрида вишни 74342 мы провели подсчет числа хромосом на стадии метафазы-11 в контрольном и опытном варианте и получили следующие результаты (таблица 13 ).
13. Плоидность гамет, формирующихся у триплоидного гибрида вишни 74342 (вишня Любская х вишня сахалинская Edwin Muller)
| Название гибрида | Число полученных растений | Диплоиды (16х) | Миксоплоиды | Тетраплоиды | |||
число | % | число | % | число | % | ||
| № 34-17-81 (смородина Призовая х крыжовник Смена) | 30 | 25 | 83,3± 1,26 | 4 | 13,3± 1,15 | 1 | 3,4± 0,61 |
Еще в первых работах по экспериментальному получению полиплоидов при регенерации побегов была использована индолилуксусная кислота (Greenleaf, 1941). Совместное применение с полиплоидизирующими химическими соединениями веществ стимуляторов, регенерации в связи с данными по онтогенетической дифференциации клеток приобретает новое значение в аспекте культуры меристематических и каллусных тканей in vitro.
В 1991 году была предпринята попытка использовать этот комбинированный метод для перевода смородинно-крыжовникового гибрида № 34-17-81 селекции доктора с.-х.н. Т.П. Огольцовой на новый уровень плоидности. Гибрид 34-17-81 (смородина Призовая х крыжовник Смена) имел набор хромосом 2n=2х=16.
Меристематическую верхушку этого гибрида вычленяли общепринятым методом (Джигадло и др., 2005). Размер экспланта составлял 0,2-0,25 мм. Питательной средой являлась среда Мурасиге-Скуга обогащенная ИУК в концентрации 3 мг/л. Пробирки с апексами, после вычленения, помещали в термостат на 6 дней при температуре 22-23°С. Освещение отсутствовало. Через 6 дней на меристематический купол наносили каплю 0,1% колхицина.
Через 72 часа меристему переносили на новую питательную среду, содержащую вместо ауксина, цитокинин (6-бензиламинопурин) 0,5 мг/л. Освещение доводили до 4 тыс.люкс. После образования конгломерата почек проводили до трех субкультур (пассажей). По достижении микрорастениями размера не менее 15 мм их пересаживали на среду укоренения. На этом этапе проводили цитологический контроль. Как видно из таблицы 14, цитологический контроль был проведен у 30 растений-регенерантов, полученных данным методом. Из них 25 растений оказались диплоидными, набор хромосом был равен 16, как и у исходной гибридной формы.
14. Плоидность растений смородинно-крыжовникового гибрида №34-17-81, полученных методом культуры in vitro

Они составили 83,3% от числа обработанных меристем, 13,3% растений были миксоплоидами, содержащими в клетках от 32, 43, 54 до 110 хромосом. И только одно растение, 3,4%, было с тетраплоидным набором хромосом, равным 32. Данное растение было размножено методом микроклонирования in vitro и проведен повторный цитологический анализ, который подтвердил тетраплоидную природу данного растения.
На сегодняшний день растения находятся в условиях открытого грунта, плодоносят. Вес ягоды до 2 г (рис. 17).
Рис. 17. Плоды и лист смородино-крыжовникового гибрида (2n=4х=32)